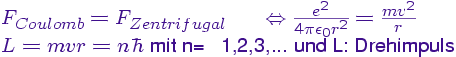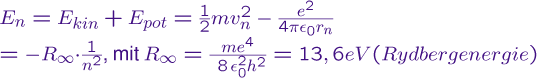|
Motivation |
Das Bohrsche Atommodell war der nächste Schritt in der Entwicklung der Atommodelle nach dem Rutherfordmodell. Rutherford nahm im Jahr 1910 an,
dass sich die Elektronen eines Atoms aufgrund der Coulombkraft in Kreisbahnen um einen positiv geladenen Kern bewegen, ähnlich einem Planetensystem.
Doch dieses Modell stand im Widerspruch zu beobachteten Phänomenen.
Aufgrund der beschleunigten Bewegung der Elektronen um den Kern (das Elektron wird in Richtung des Rotationszentrums beschleunigt,
da es sich sonst auf keiner Kreisbahn bewegen würde), müsste das Elektron ständig Energie abstrahlen, ganz wie ein elektrischer Dipol.
Dies würde zu einer Verringerung des Kreisbahnradius führen und damit zu einer Erhöhung der Kreisfrequenz, die ausgesandte Strahlung
würde nach kürzester Zeit immer höhere Frequenzen haben. Da die Elektronen letztendlich sogar in den Kern stürzen würden
gäbe es gar keine stabilen Atome. Da man wusste, dass die beobachteten Spektren extrem frequenzstabil sind und es offensichtlich sehr viele stabile
Atome gibt, war klar, dass ein neues Atommodell gefunden werden musste.
|
|
Prinzip |
Zur Aufhebung dieser Widersprüche stellte Niels Bohr 1913 zwei Postulate auf und formte damit ein neues Atommodell:
- Die Elektronen eines Atoms können sich nur auf bestimmten stabilen Kreisbahnen bewegenund emittieren dabei
keine Strahlung.
.
- Zwischen den stabilen Bahnen mit der Energie E sind Elektronenübergänge möglich. Die dabei in Form von elektromagnetischer
Strahlung absorbierte oder emittierte Energie entspricht der Differenz zwischen den Energien des Anfangs- und Endzustandes.

Man sieht sofort, dass die Frequenz des Lichts ν proportional zur Energiedifferenz der beteiligten Bahnen ist.
Mit diesen Postulaten kann man nun ziemlich einfach die einzelnen Energieniveaus berechnen, wobei die Ergebnisse für
das Wasserstoffatom sehr gut mit den experimentellen Werten übereinstimmen (bei den anderen Atomen ist selbst das Bohrmodell
schon wieder zu ungenau).
Nach dem ersten Postulat bewegen sich die Elektronen auf Bahnen um den Kern, wobei die anziehende Coulombkraft durch die Zentrifugalkraft
des Elektrons kompensiert wird.
Weiterhin gehört zu den Postulaten, dass der Drehimpuls gequantelt ist und nur ganzzahlige Vielfache des Planckschen Wirkungsquantums
einnehmen kann.
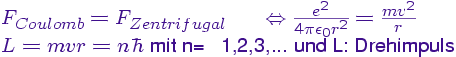
Der kleinste Radius, der sich für die Hauptquantenzahl n=1 ergibt wird dabei als Bohrscher Radius bezeichnet, er liefert eine Abschätzung
für die Größe des Atoms. Die Gesamtenergie eines
Elektrons auf einer bestimmten Schale (Die möglichen Bahnen für die n=1,2,3 werden auch als Schalen, oder Orbitale bezeichnet und
mit den Buchstaben K,L,M,... versehen.) kann auch leicht errechnet werden:
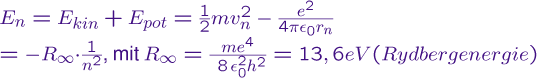
Für eine detailliertere Erläuterung des bohrschen Atommodells schlagen Sie beispielsweise im Buch zur Vorlesung nach.
["Ein Jahr für die Physik", C. Thomsen, H. G. Gumlich, 2.Auflage, S.239 ff]
|
|
Aufgaben |
- Aufgabe1
a) Berechnen Sie den Bohrradius eines Wasserstoffatoms
b) Berechnen die Wellenlänge eines emittierten Photons beim Übergang von der Hauptquantenzahl n=2 auf m=1.
c) Es wird der Übergang von n=108 auf n=107 beobachtet. Welche Wellenlänge hat diese sogenannte H107 α Linie?
d) Berechnen Sie die Ionisierungsenergie und vergleichen Sie diese mit der Rydbergenergie.
Lösung
- Aufgabe2
Applet aus der Sammlung von Walter Fendt,
http://www.walter-fendt.de/ph11d/
Dieses Applet stellt ein Wasserstoffatom wahlweise im Teilchenbild oder im Wellenbild dar. In einem Auswahlfeld lässt sich die
Hauptquantenzahl n variieren. Im rechten Teil sind die Energieniveaus des Atoms dargestellt. Am unteren Rand lassen sich
Bahnradius r und Gesamtenergie E ablesen.
Wenn man versucht, mit gedrückter Maustaste den Bahnradius zu verändern, führt dies im allgemeinen auf einen
nicht-stationären Zustand. Dies ist in der Einstellung "Wellenbild" daran erkennbar, dass die grüne Wellenlinie,
die die Materiewelle symbolisiert, nicht geschlossen ist.
a) Überprüfen Sie den aus Aufgabe 1 a) errechneten Bahnradius.
b) Überprüfen Sie die in Aufgabe 1 b) berechnete Wellenlänge beim Übergang von n=2 in den Grundzustand (n=1).
c) Wechseln Sie in den Modus "Wellenbild" und überlegen Sie sich was in diesem Bild die Zahl n bedeuten könnte.
Lösung
|
|
Quiz
|
Unter dem folgenden Link finden Sie ein Quiz, an dem Sie ihr Wissen über das bohrsche Atommodell
überprüfen können:
Quiz
|
|
Links
|
|
|
Fragen
|
Falls Sie Fragen zu einer der Aufgaben oder allgemein zu diesem Thema haben, dann posten Sie diese doch einfach ins
Forum
, wir werden sie dann beantworten.
|
|
|
|