|
DAS WELLENMECHANISCHE ATOMMODELL DES WASSERSTOFFATOMS Nimmt man die Energieberechnung des elektrischen Felds, zur Hilfe, so ergibt sich für die potentielle Energie
eines Elektrons im Wasserstoff-Atom
|
|
|
e2 |
(G18) |
Epot = |
- |
|
|
|
|
4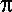 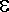 0r 0r |
Führt man den Abstand zwischen Elektron und Atomkern r als Variable ein, so berechnet r aus
|
|
|
|
|
|
(G19) |
r = |
\ |
|
/ |
x2 + y2 + z2 |
|
|
|
\/ |
|
|
Man setzt den Ansatz
|
|
|
- |
r
a |
(G20) |
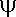 1= 1=
|
C e |
|
|
|
|
|
|
|
in die Schrödinger-Gleichung ein und es ergibt sich eine kugelsymmetrische Lösung. Der Abstand r und Energie E1 wird wie folgt berechnet wird wie nach Bohrschen Vorstellungen
berechnet. Die Konstante C ist noch nicht bekannt.
|
|
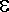 0h2 0h2
|
(G21) |
a = |
|
|
|
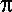 me me
|
|
|
|
|
|
me e4 |
(G22) |
E 1 = |
|
|
|
8 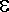 02h2 02h2 |
Die Wahrscheinlichkeistdicht 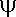 12ist das Quadrat der Wellenfunktion. 12ist das Quadrat der Wellenfunktion.
|
|
|
- |
2 r
a |
(G23) |
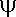 12= 12=
|
C 2 e |
|
|
Eine Integration über das gesamte Volumen muß 1 ergeben, da die Wahrscheinlichkeit es dort anzuttreffen 1 ist.
Weil dV = 4 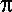 r2 dr, folgt r2 dr, folgt
|
|
|
|
|
2 r |
|
|
|
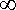
|
|
- |
|
|
(G25) |
4 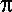 C2 C2 |
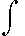
|
r2 e |
|
a |
dr |
|
|
0 |
|
|
|
|
und wiederum daraus
|
|
|
|
|
|
- |
2r
a |
|
a3
4 |
(G26) |
C2 = |
1
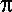 a3 a3 |
mit |
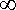
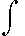
0
|
r2e |
|
|
dr = |
|
|
|
|
|
|
|
|
|
|
|
Endlich erhält man die Wahrscheinlichkeitsdichtefunktion
|
|
|
|
- |
2r
a |
|
|
|
|
1 |
|
|
|
|
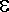 0h2 0h2
|
(G27) |
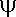 12 = 12 =
|
|
e |
|
|
mit a = |
|
|
|
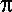 a3 a3
|
|
|
|
|
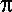 mee2 mee2
|
|
|
|
|
|
|
|
|
Die Wahrscheinlichkeitsdichtefunktion führt aber zu dem Widerspruch, daß Elektronen wohl kaum in Atomkernnähe sich am häufigsten aufhalten. Die Funktion wird deshalb genauer formuliert.
Die Wahrscheinlichkeit W berechnet sich aus
(G28) W = | 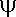 |2
und Elekronen kommen vorrangig nur im Volumenelement |2
und Elekronen kommen vorrangig nur im Volumenelement 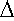 V - einer
dünnen Kugelschale der Radien r und r + V - einer
dünnen Kugelschale der Radien r und r +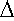 r. r.
(G29) W = | 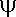 |2 4 |2 4 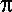 r2 r2 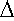 r r
mit 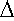 V=4 V=4 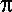 r2 r2  r. r.
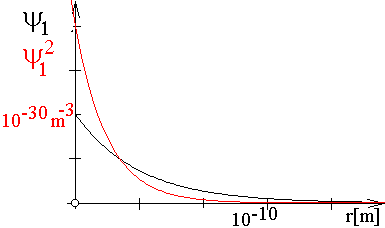
Legende:
schwarz 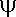 als Funktion des Radius r (Wahrscheinlichkeitsaplitude, Grundzustand)
als Funktion des Radius r (Wahrscheinlichkeitsaplitude, Grundzustand)
rot 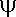 2
als Funktion des Radius r (Wahrscheinlichkeitsdichte) 2
als Funktion des Radius r (Wahrscheinlichkeitsdichte)Der erste Zustand des Elektrons im Wasserstoffatom hat folgende Wahrscheinlichkeiten.
|
|
|
|
- |
2 r
a |
|
|
|
(G30) |
W1 = |
4 r2
a3 |
e |
|
|
 r mit r mit
|
a = |
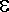 0h2 0h2
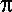 me e2 me e2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
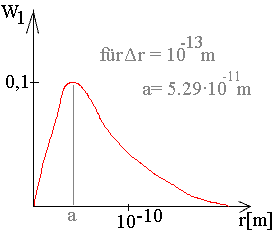
Die Wahrscheinlichkeitsfunktion W hat im Bohrschen Radius a=5,29 10-11ein Maximum.
Die räumliche Darstellung bringt eine Wahrscheinlichkeistwolke hervor, und in
der Chemie wird diese Orbital genannt. Es ist der Raum nämlich, in dem Elektronen zu 90%iger Wahrscheinlichkeit angtroffen werden kann. Bei einem Energiezustand n gibt es n2 Lösungen nach
der Schrödinger-Gleichung. Im zweiten Energiezustand liegen deshalb zwei verschieden |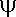 |2
-Funktionen unterschiedlicher räumlicher Konstitution vor. |2
-Funktionen unterschiedlicher räumlicher Konstitution vor. |
Legende:
Die Wahrscheinlichkeitsfunktion W1
des Wasserstoffatomsgibt an, mit welcher Wahrscheinlichkeit das Elektron in einer Kugelschale mit dem Radius r und der Dicke 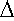 r = 10-13 m zur Wirkung kommt. r = 10-13 m zur Wirkung kommt.
|
Um die möglichen verschieden angeregten Zustände des Elektrons den möglichen Wellenfunktion zuzuordnen, ist es sinnvoll sogenannte Quantenzahlen einzuführen. |