|
ÜBERLEGUNGEN ZUR WELLENMECHANIK Anhand eines einfachen Experiments und einer darauf basierenden Überlegung wird die Problematik der Wellenmechanik dargelegt. Man
stelle sich einfach vor, daß ein Elektron in einem eindimensionlen Behälter sei (einem linearen Potentialtopf). Wenn man eventuelle Bewegungen in Betracht zieht, dann erweist sich nicht um „Ruhe" handelt, sondern um
eine stehende Welle. Ein stationärer Zustand könnte hiernach eine stehende Welle sein.
Um diesen Sachverhalt zu beschreiben, führte S. eine rein mathematische Überlegung durch, die sich aber praktisch als sehr
einfach erweist: Die sogenannte  -Funktion. -Funktion.
Mechanischer Analogverusch - stehende Welle
Durchführung:
Ein Extender bringt mit sinkender Wellenlänge der Länge l eine Saite zum Schwingen.
Beobachtung:
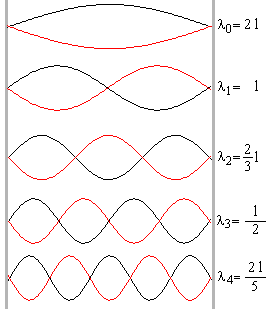
Bei einer bestimmten Frequenz kommt es zu
stehenden Wellen. Nach einem bestimmt Abstand kommt es wieder zu stendenden Wellen. Nur wenn eine ganze Anzahl von halben Wellenlängen in die festen Wände paßt, treten die Knoten und Bäuche der stehenden
Welle auf. Dabei gilt:
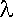 n= n=
|
2 l
n + 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Gedankenversuch zum eindimensionales Modell
Man überträg diesen Sachverhalt auf ein Elektron, das sich in einem Rohr frei bewegen kann und auf das
keine Kraft wirkt, dessen potentielle Energie Null sei, und von Wänden mit dort unendlich großer potentieller Energie umgeben sei. Nach Heisenbergs Umbestimmtheitsrelation ist
|
|
h |
|
|
|
|
|
(G1) |
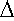 x x 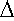 p >= p >=
|
|
|
=> |
(G2) |
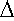 x x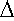 p p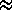 h
|
|
|
|
2 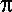 |
|
|
|
|
|
Wenn 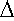 x die Länge des Potentialtropf a ist, x die Länge des Potentialtropf a ist,
dann gilt für den Impuls der Unschärfe: |
|
|
h
|
|
|
|
|
|
(G3) |
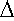 p p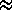
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
|
Für die Funktionen gilt demnach:
|
|
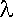
|
|
|
|
|
(G4) |
|
|
n=a |
; n=1,2,3,4.. |
|
|
|
|
2 |
|
|
|
|
Nach Umstellen und Substituieren der Gleichung (G1)
und der De Broglie Hypothese |
|
|
h |
|
|
|
|
(G5) |
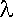 = =
|
|
gilt dann |
|
|
|
|
|
me v |
|
|
|
|
|
|
h n |
|
|
|
|
(G6) |
v = |
|
|
|
|
|
|
|
2 a me |
|
|
|
|
Die gesamte Energie des Elektrons berechnet sich aus: |
|
|
|
|
1 |
|
|
(G7) |
E = Epot |
+ E kin = |
0 + |
|
me v2 |
|
|
|
|
|
2 |
|
|
Die Kombination mit der Gleichung (G4) ergibt sich: |
|
|
h2 |
|
|
|
|
(G8) |
En = |
|
n2 |
|
|
|
|
|
8 a2 me |
|
|
|
|
Deswegen ist tritt die Energie des Elektrons Quantenportionen auf,
wobei sie proportional der Quantenzahl n zunimmt.
Daraus ergibt sich für ein Teilchen der Masse m folgendes: |
|
|
h2 |
|
|
|
|
(G9) |
En = |
|
|
|
|
|
|
|
8 a2 m |
|
|
|
|
Auch bei einer Temperatur von 0 Kelvin gilt dieses Gleichung.
Die Quantenzahl n nimmt im BOHRschen Atommodell die Nummer der Bahn ein, nur daß beim Wellenmodell sich die Quantenzahl zwangläufig ergibt. Denkbare Realisierung
Um Potentialwände zu erzeugen, erzeuge man ein elektrisches Feld zwischen einem negativ geladenen
Bleche und einem positiv geladenen Maschendrahtnetz, das Elektronen nicht behindert. Durch eine winzige Öffnung durchgeschossen wird ein Elektron zwischen den Potentialwänden ständig reflektiert.
Schrödinger setzte sich das Ziel, aus einem bestimmten Potentialverlauf die passende y-Funktion zu gewinnen, und ihr anschließend die Energiewerte zu berechnen.
Parabelförmiger Potentialtopf
Jedoch sind Atome nicht linear. Betrachten wir also zuerst eine parabelförmigen Potentialtopf.
|
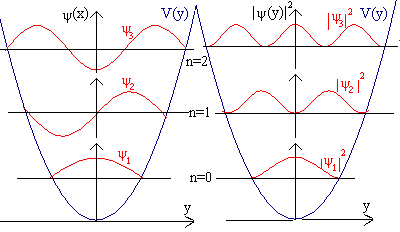
Legende der Abbildung rechts:
links: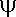 -Funktion -Funktion
rechts: Wahrscheinlichkeitsdichte | |2 |2
Je höher die Funktionwerte des Wahrscheinlichkeitsdichte sind, desto öfter
kann das Elektron am Ort y angetroffen werden.
Wächts die Knotenzahl der stehenden Welle, so gibt es auch mehrere Bereiche, bei denen das Elektron mit großer Wahrscheinlichkeit angetroffen
werden kann.
Mögliche Zustände für unterschiedlichste Knotenzahl des drei-dimensionalen Raums und den Bezug zur Energie zu finden, machte sich Schrödinger zur Aufgabe. |
|
